美國聯邦食品暨藥物管理局(FDA)7日批准有助減緩阿茲海默症認知退化的藥物阿杜卡奴單抗「Aducanumab」,隨後幾天接獲許多家屬詢問:台灣何時可以施打這藥?好像近來民眾搶著要施打預防新冠疫苗的心情,對阿茲海默症家屬的心情我完全可理解,因為我也曾是其中一員,但建議家屬先看清楚藥物的功效、對象、副作用等,想清楚後再做決定。
美國時間6月7日白天,正是台灣的晚上,我等著FDA的新聞稿,看到FDA網站「FDA Grants Accelerated Approval for Alzheimer’s Drug」,一則以喜,一則以憂,喜的是盼望已久有效的藥品終於露出「曙光」,憂的是副作用、價格、效果等都還是未定論,我還是立即寫了一篇3600字的文章,將這訊息詳細說清楚,讓關心的民眾瞭解這藥物的來龍去脈。
但仍有家屬急著問:台灣何時可以施打這藥?
換言之,他們可能欣喜若狂到無法仔細閱讀文章中的每一細節,因此決定將家屬關心的問題一一詳列並作答。
Q1.台灣何時可以施打這藥?
由美國藥廠百健(Biogen)與日本藥廠衛采(Eisai)共同研發的這種新藥「Aducanumab」,將以品牌名「Aduhelm」上市,美國FDA批准後,百健CEO表示,Aduhelm將在10天至兩周內於美國上市,換言之,6月21日該周可上市。根據6月10日紐約時報的報導,百健藥廠已與全美超過900多家記憶門診等醫療單位合作,為新藥推出預做準備。
衛采材負責在日本、中國和韓國等亞洲的銷售,該藥已在去年12月向日本厚生勞動省申請批准,有關部門正在進行審查。
至於台灣,要等衛采正式向台灣衛福部食品藥物管理署申請,得到核准之後,才有機會在台灣施打。明確時間要看衛采何時提出申請,傳聞是要到今年底才會送件。
Q2.「Aduhelm」對甚麼樣的患者「可能」會有效?
這要從百健針對「Aducanumab」的臨床研究所施打的對象成效來看,臨床實驗中,這款藥品是以阿茲海默症初期患者做為研究對象。研究對象當中並未包括病情已進入中度阿茲海默症患者,開始失去生活自理能力也無法自我進食的患者。
所以是對輕度認知障礙(MCI)及極輕度阿茲海默症患者,Aduhelm「有可能」影響疾病潛在的病理生理學,減緩認知及功能衰退,並有助於提高患者的日常生活能力。
換言之,是針對腦部已開始產生阿茲海默症病理變化,但認知功能只有輕微影響的患者。患者使用Aduhelm之前,可能必須先接受認知測驗,確定認知症(dementia)類型的確是因為阿茲海默症引起。若是以鑑別診斷工具來看,簡易智能量表(Mini-mental state examination ,簡稱MMSE)分數大於24分,臨床認知症評估量表(Clinical Dementia Rating, CDR)為0.5的極輕度的患者。
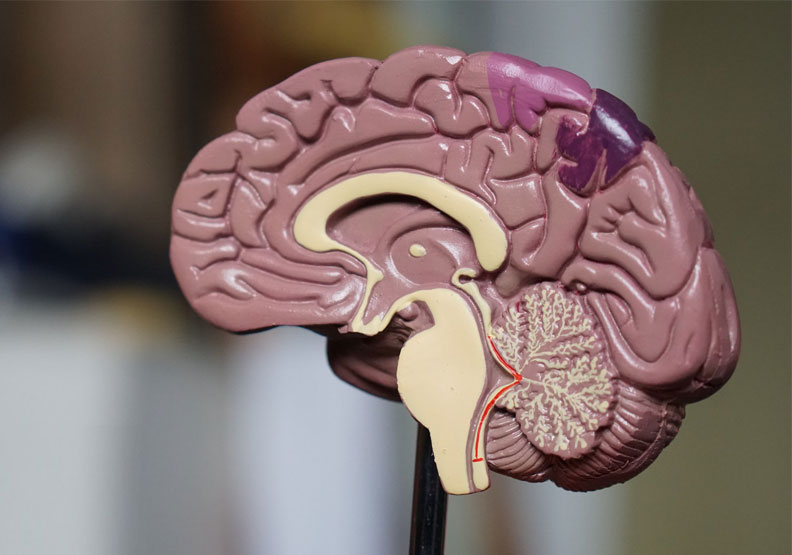
Q3.如何確定大腦內是否有β類澱粉蛋白(amyloid beta,簡稱Aβ)類澱粉蛋白的沉積?
Aduhelm的臨床研究設計是針對阿茲海默症患者腦中的β類澱粉蛋白斑塊,所以要施打Aduhelm前,要能證實患者腦中已有β類澱粉蛋白沉澱。
目前在台灣醫學領域有兩種方式可進行測試,一是測腦脊髓液中β類澱粉蛋白的含量,這需要做腰椎穿刺才能取得腦脊髓液,腰椎穿刺術是以無菌技術利用細針穿過第三、四或第四、五腰椎部位的皮膚、皮下組織和脊椎骨中間的空隙,到達脊髓的蜘蛛膜下腔附近,留取少量腦脊髓液進行顱內壓力測量、檢查、檢驗或引流腦脊髓液。
腰椎穿刺是一侵入性醫療行為,常見的副作用可能發生頭痛、頭昏、噁心、嘔吐、頸肩痛等症狀,尤其是站立或坐著時症狀加劇。
另一則是類澱粉蛋白的正子造影檢查,此檢查雖較無侵入性較方便,但和斷層掃描一樣,會接受小量幅射,目前健保也未給付,自費價格約為7到8萬元,檢查時間約需15至20分鐘。
Q4.「Aduhelm」的治療過程如何?
「Aduhelm」藥品需由阿茲海默症專科醫師開立處方,每月靜脈注射一針,啟動患者體內的反疫反應,清除腦部類澱粉蛋白斑塊。
根據藥廠建議,每三個月須接受腦部磁振造影(MRI)追蹤,以密切觀察施打用藥後腦部是否產生變化、藥物作用及安全性,以目前的試驗數據來看,至少要連續治療12個月後,才出現臨床上「可減緩」病程的效果。
Q5.「Aduhelm」施打後效果會如何?
Aduhelm的臨床研究設計是針對阿茲海默症患者腦中的β類澱粉蛋白斑塊,減緩病情,讓患者「盡量」可以恢復生活自理。
百健研發的新藥Aduhelm是第一款可「減緩」腦部功能退化的新藥,但藥品並不是治療阿茲海默症的解藥。百健強調,這款藥品並不會治好阿茲海默症,但能讓患者的生活自理,並爭取更多寶貴時間與家人相處。
英國國家廣播公司BBC醫學編輯弗格斯·沃爾什(Fergus Walsh)表示,這不是什麼神奇藥物,也不能根治阿茲海默症,但這是對付大腦內導致神經元損毀的破壞機制的首個療法。
Q6.「Aduhelm」會出現何種副作用?
目前看到藥物進行臨床實驗中顯示,副作用包括大腦輕微水腫、發炎、微出血反應等。有些人可能會出現頭痛等症狀、意識模糊、頭暈、視力改變或噁心。Aduhelm 的另一個副作用是過敏反應的風險,包括血管性水腫和蕁麻疹。Aduhelm 最常見的副作用是 ARIA、頭痛、跌倒、腹瀉和意識模糊、譫妄、精神狀態改變、定向障礙等。
臨床實驗中,某些使用最高劑量的患者由於出現腦部腫脹,必須接受進一步觀察。統計顯示,對於阿茲海默症屬於遺傳易感性(genetic predisposition)的患者,腦部腫脹的副作用風險最高。頭疼也是在臨床實驗中發現的新藥副作用。
FDA指出,未來阿茲海默症患者使用Aduhelm新藥如果出現腦部腫脹,必須接受觀察,但不一定需要停止用藥。
Q7.「Aduhelm」為何「可能」有效?
Aducanamub是針對β類澱粉蛋白的單株抗體藥物,目標在清除β類澱粉蛋白,以減少阿茲海默症的病理變化。這也為何要先確認是阿茲海默症患者,確定患者腦內β類澱粉蛋白沉積達一定的量,Aduhelm才有機會發揮預期的功效。
Aduhelm新藥所採取的方式,是擷取人體本身的抗體,並重新調整成為可針對、並降低阿茲海默症致病的腦中β-類澱粉蛋白濃度——在理想狀況中,Aduhelm「或可阻止」、「甚至清除」β-類澱粉蛋白的堆積,進而守護患者的認知能力、阻斷病程的持續惡化。
另一被視為可能有效是選擇了最大限度增加用藥量的方法。普通抗癌藥使用的抗體藥物的用藥量為體重1KG服用3~5毫克左右,Aduhelm為10毫克,是普通藥物的2倍以上,經過大約1年半的臨床試驗發現疾病進展速度可延緩2成,但用藥量少的患者人群沒有明確的效果。
此前的藥物僅僅能針對症狀進行治療,但無法延緩疾病的進程。
Q8.為何施打「Aduhelm」後的答案中,會有那麼多的「可能」?
聯邦食品暨藥物管理局批准百健新藥Aducanumab上市,是在專家仍有許多存疑與爭議中,是以加速批准(accelerated approval)核准新藥的「有條件上市」——未來,百健必須定期提出追蹤佐證報告(post-approval studies)及驗證性試驗(confirmatory trials),以擴大確認「高劑量有療效」的三期結論;與此同時,新藥可同步上市使用,但若百健未能一月提出可靠報告、或者後續應用無法證明三期有效結論,FDA則有權撤銷現Aducanumab的上市藥證。
Q9.Aducanumab在臨床實驗第三期出現什麼樣的爭議?
三期臨床試驗中,百健分別對Aducanumab進行了兩場代號ENGAGE 301和ENGAGE 302的三期試驗,兩場實驗設計相同,但結果卻截然相反。其中一個試驗組確實出現了β-類澱粉蛋白斑塊減少的情況,另一組組卻沒有。這也是引起科學界巨大爭議的原因。
在301號實驗中,接受高劑量Aducanumab治療的患者組的認知能力CDR-SB評分升高了2%(代表認知障礙症狀惡化),但在302號實驗中,患者認知能力CDR-SB評分卻降低了22%(代表症狀改善)。
百健公布的數據亦顯示,接受高劑量Aducanumab的患者中,約35%出現大腦水腫症狀,約18%至22.7%出現微出血症狀。
試驗結果出爐後,百健於2019年3月提前叫停試驗,令外界一度以為Aducanumab已經胎死腹中。不過同年10月,百健又突然宣布將向FDA提交上市申請,理據是公司分析更多數據後,認為兩項實驗結果都朝着「對患者有利的方向發展」。
百健於2020年7月正式向FDA提交申請,不過FDA獨立專家委員會11月對藥物有效性進行表決時,幾乎所有專家都投了反對票,以10票反對、1票未決定,判定該研究不能被視為療法有效的主要證據,認為沒有充分證據證明Aducanumab治療阿茲海默症的有效性,而且百健未能對兩次三期試驗出現相反結果提出令人信服的解釋。
除了資料上的自相矛盾和不連續性讓專家學者對於新藥生疑,Aduhelm的潛在副作用同樣令許多此領域醫療工作者憂心。
百健的公開資料顯示,大約40%的受試者在注射高劑量Aduhelm後腦腫脹或出血的情況。雖然這通常沒有症狀,但一些患者會出現意識模糊、定向障礙和跌倒的情況。這個副作用也促使高劑量組中6%的受試者終止試驗。
此一爭議延續到FDA於6月7日宣布,批准阿杜卡奴單抗「Aducanumab」上市之後,到6月10日為止,FDA的十一位周邊及中樞神經系統藥品諮詢委員會(Peripheral and Central Nervous System Drugs Advisory Committee)已有三位成員陸續宣布辭職,以示抗議FDA的決議。
Q10.如果施打高劑量的「Aduhelm」會出現腦腫脹或出血的情況,是否不要施打那麼高的劑量,同樣可以達到預期減緩退化的效果?
百健對臨床試驗資料的分析指出,讓患者持續接受高劑量Aduhelm治療,能夠導致患者大腦中β-類澱粉蛋白水準降低幅度更大,而且這些患者中的認知能力下降的速度也得到了更為顯著的延緩。所以百健是以高劑量Aduhelm進行治療,才能產生顯著延緩的效果。
這些結果可能意味著,靶向β-類澱粉蛋白的療法需要將大腦中的β-類澱粉蛋白降低到足夠低的水準,才能夠觀察到延緩認知能力下降方面的效果。
Q11.如果專家諮詢委員會的11位外部專家有10位反對,為何FDA會批准Aduhelm上市?
FDA批准百健新藥Aduhelm上市,是以加速批准(accelerated approval)核准新藥的「有條件上市」方式,給以加速批准核准新藥的目的,在治療初步證據顯示有可能解決未滿足的醫療需求的嚴重疾病;相對於現有療法具有顯著優勢;具有改善替代終點或臨床終點。
FDA指出,衡量藥物對阿茲海默症的益處,大於風險。
但也有媒體提出FDA是在科學、社會需求、與論壓力、經濟市場等中取得平衡點,在美國,阿茲海默症是第六大致死原因。美國阿茲海默症協會、阿茲海默症影響運動(AIM)等民間團體極力推動與遊說,
美國有超過600萬名阿茲海默症患者,患者及其家屬對批准新藥的呼聲,多年來十分強烈。美國阿茲海默症協會預測,到2050年,全國患者將從目前600萬人增加至1300萬人。
經濟市場方面的壓力,可從百健領軍生物科技股,在7日FDA宣布批准之後,立即大漲38.34%,報395.85美元,市值就增加了165億美元。衛采在美交易上漲56%,收報每股116.03美元。
根據百健藥廠估計,全美約有150萬民眾符合使用Aduhelm新藥的資格。Aduhelm僅在美國,就有可能為百健帶來50億美元到60億美元的銷售額。
Q12.如果施打「Aduhelm」,需要多少費用?台灣的健保是否會給付?
目前衛采尚未向衛福部提出申請,也未宣布日本、台灣等亞洲國家的價格。若以美國百健所宣布,Aduhelm在美國的零售價格將是每一劑4312美元,而每4週必須注射一劑,至少要連續施打一年,一年費用就是5萬6000美元(約台幣155萬元)。
健保給付與否須要通過審議委員會的審查,根據全民健康保險藥物給付項目及支付標準,目前衛采都尚未申請藥證,健保署更無法審查。但以美國的例子來參考,美國各家保定,會由精算師去計算。另外,患者可能還要負擔診斷檢測的部分費用以及副作用出現後的觀察檢測費用。
(本文作者為認知症整合照護專家,長照、認知症政策研究者)


