「高端解盲」眾所矚目!今(10日)下午五點,高端舉行線上記者會,自行宣布「解盲成功」,表示將立即申請台灣緊急使用授權(EUA),希望最早7月就盡快供應國內新冠疫苗。然而,衛福部次長石崇良卻說,仍待委員會審查通過才會決定,「目前沒有時程表!」
今年初開始,高端在全台的北中南共11家醫院收案,總共收案逾4000人,超過原來預期的3700人。其中,65歲以上族群收案大約85位,也超過衛福部所建議取得EUA的受試者人數。
記者會開始,高端也隨即發布新聞稿表示, 6月10日的期間分析,共計涵蓋3815名有效受試者,最高齡受試者達89歲。並以所有受試者兩劑疫苗施打完成後一個月,以及中位數受試者完成疫苗施打後兩個月的數據,進行安全性與免疫生成性評估。
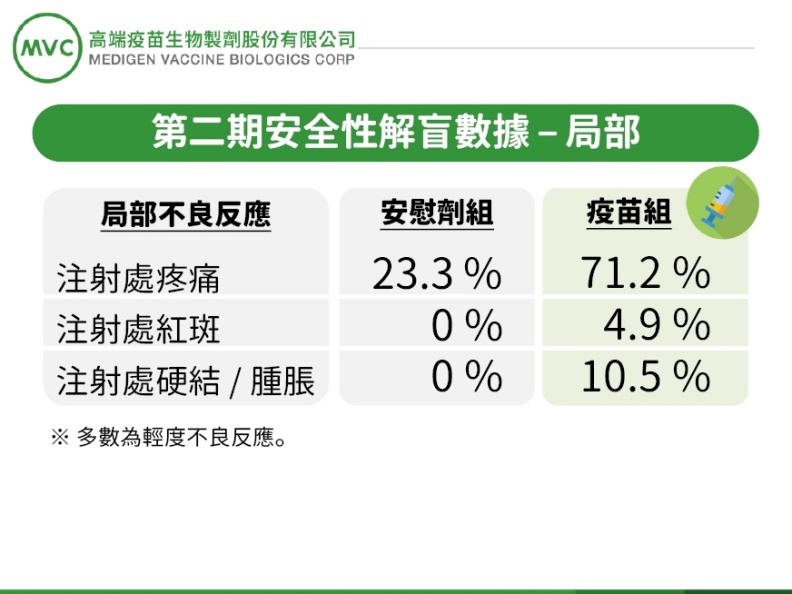
 圖/高端二期解盲數據。高端提供
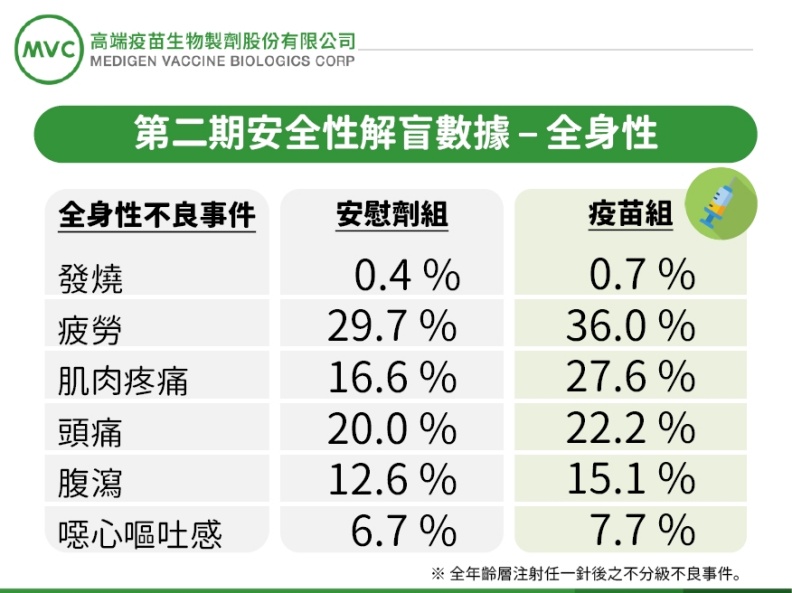
圖/高端二期解盲數據。高端提供
高端:解盲成功,將申請台灣EUA!
高端疫苗總經理陳燦堅表示,此臨床試驗已於5月28日達到所有受試者第二劑疫苗施打後一個月、以及中位數受試者追蹤兩個月的期間分析條件。受試者血清也依照官方要求,由中研院P3實驗室檢測野毒中和抗體效價,並已完成檢測。

高端疫苗執行副總李思賢也指出,新冠肺炎疫苗期間分析數據顯示:
1.安全性與耐受性良好,所有受試者未出現疫苗相關嚴重不良反應。
2.在免疫生成性部分,不區分年齡組情況下,疫苗組在施打第二劑後28天的血清陽轉率(seroconversion rate)達99.8%。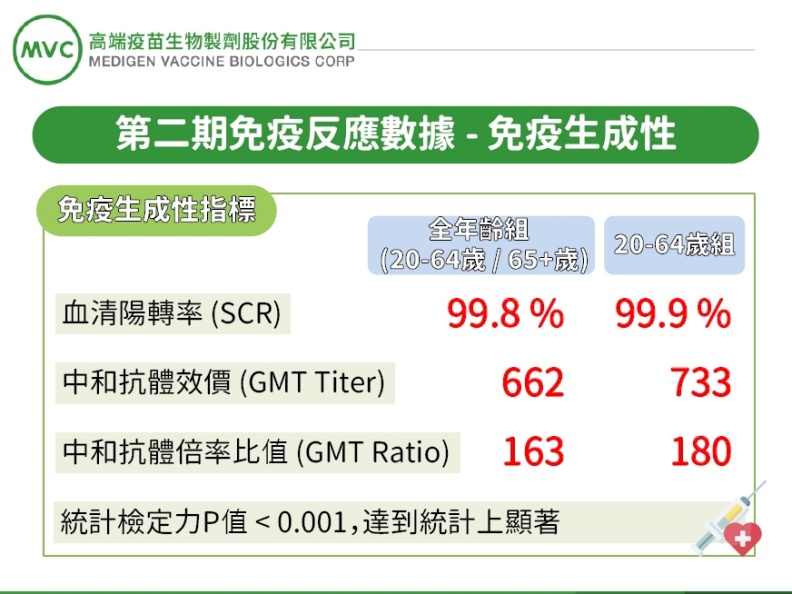
中和抗體之幾何平均效價(GMT titer)為662,GMT倍率比值為163倍增加。而20~64歲之疫苗組,血清陽轉率則為99.9%,中和抗體幾何平均效價(GMT titer)為733,GMT倍率比值為180倍增加。
爭議不斷!二期解盲就申請EUA,恐缺國際認證
不過,高端僅二期解盲就申請EUA,也引發許多爭議。例如,台大醫院臨床試驗中心主任陳建煒就認為,高端這次要檢視的二期臨床數據中,只檢視「安全性」和「免疫生成性」,缺乏「保護力」的驗證。
何況,高端即使拿到台灣TFDA(食藥署)核發的EUA,但因為沒有做第三期,也可能無法得到國際認證,無法取得「疫苗護照」。對此,高端表示,在解盲後將同步向歐盟提出申請,準備展開三期臨床試驗、與國際標準接軌。
TFDA在今天早上才公布EUA審查標準,明顯是要搶在高端解盲之前,但仍然引發爭議。簡單來說,TFDA的審查標準是國產疫苗二期臨床試驗所得的中和抗體效價,必須證明不能比AZ疫苗來得差,才會核發EUA。

不過,因為WHO(世界衛生組織)並未有相關界定,因此,TFDA此次標準還有個但書,那就是,若在申請EUA之前,WHO就訂出了國際共同遵循的中和抗體保護力相關指標閾值,那麼,一切就參考WHO標準。
看來,國產疫苗之爭不會隨著高端解盲落幕,恐怕還是有賴WHO出面給一個說法了。