國衛院發現抑制攝護腺癌細胞轉移新標的,剔除KDM4C可調節糖解作用,證明KDM4C基因對抑制癌細胞代謝扮演關鍵角色,國內外學者已著手開發KDM4C抑制藥,新藥有望5年後問世。
攝護腺癌位居台灣民眾癌症死因第5名,死亡年增率居冠,過去40年來罹患率與死亡率均逐年增加,去年攝護腺癌就奪1689條人命,事實上,攝護腺癌細胞沒有轉移的情況下,患者的5年存活率幾乎可達100%,顯示抑制攝護腺癌細胞轉移重要性。

國衛院細胞及系統醫學研究所副研究員褚志斌研究團隊利用攝護腺癌細胞進行研究,發現剔除KDM4C後的癌細胞,與醣類、蛋白質與脂肪代謝的重要基因與蛋白質都有被抑制的現象,細胞內粒線體能量代謝跟有氧呼吸功能都出現失能。
褚志斌說明,研究也顯示讓癌細胞賴以為生的糖解作用訊號與產生ATP能量代謝的路徑,也受到抑制,證明KDM4C基因對癌細胞代謝扮演關鍵角色。此研究成果於今年3月發表在國際期刊Clinical and Translational Medicine。
褚志斌說,癌細胞為了快速分裂,常利用步驟較少產能效率較低的無氧糖解快速產生能量,而非步驟較複雜但產生能量較多的有氧糖解,這種特殊代謝現象稱為瓦氏效應(Warburg effect)。
癌細胞可利用無氧糖解代謝產物作為細胞增生分裂的原料,代謝產生的乳酸還會酸化腫瘤環境幫助癌細胞轉移,因此如何抑制癌細胞的無氧糖解作用,成了癌症醫療的關鍵問題之一。
褚志斌說,透過臨床檢體分析、細胞與動物實驗,發現攝護腺癌新治療標的「組織蛋白去甲基酶KDM4C」,KDM4C透過去甲基來活化基因,並與致癌蛋白c-Myc結合、促進葡萄糖糖解代謝、活化乳酸去氫酶LDHA,促進丙酮酸轉化為乳酸、酸化周邊環境而促進癌症轉移。
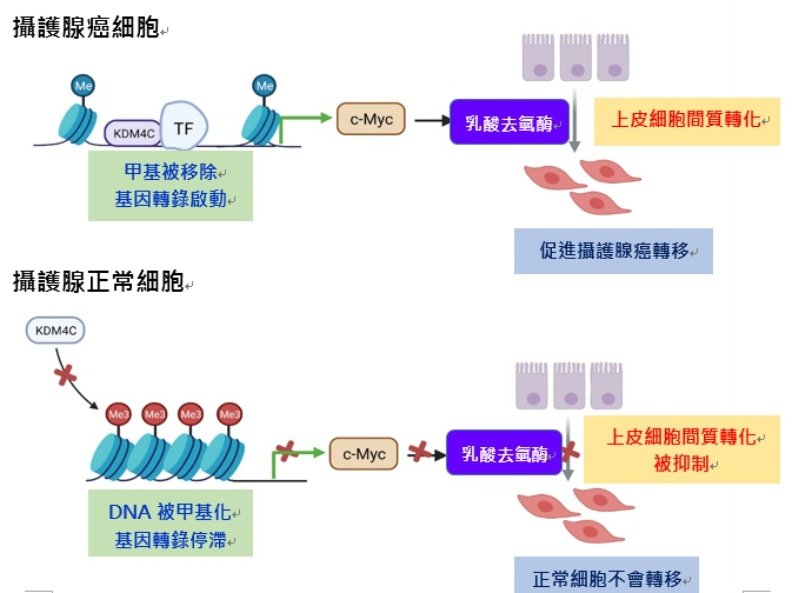
褚志斌表示,抑制攝護腺癌細胞KDM4C的表現量,可抑制瓦氏效應和攝護腺癌的轉移,目前已有部分KDM4C抑制劑被研發,若專一性與效性提升,將有機會成為預防攝護腺癌轉移的新藥,達到阻絕或延緩攝護腺癌轉移的新治療方針,樂觀預估新藥有望最快在5年後問世。
本文轉載自2022.07.11「中央社」,僅反映作者意見,不代表本社立場。



 Just For You
Just For You
