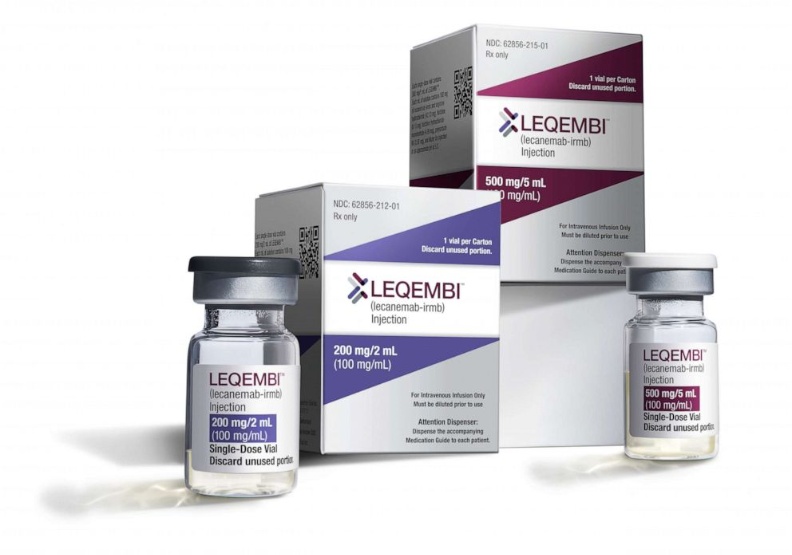
美國聯邦食品暨藥物管理局(FDA)於2023年1月6日加速批准(Accelerated Approval pathway)了阿茲海默症新藥Lecanemab(侖卡奈單抗),而商品名是Leqembi。但百健及其日本合作夥伴衛采Eisai於前年2021年6月7日,獲得FDA批准的阿茲海默新藥Aduhelm,卻遭遇到醫界與市場對該藥安全性的疑慮,Lecanemab是否會出現相同的命運,成為眾所矚目的焦點。
2022年12月22日衛采曾在中國宣佈,Lecanemab侖卡奈單抗注射液在中國提交的上市申請獲得了中國藥監局審評中心的受理,其適應症為輕度阿茲海默症和輕度認知障礙(MCI)的改善治療。至於何時會在台灣向衛福部申請上市許可,仍得等待衛采在台灣公司的宣布。
FDA對Lecanemab的批准未受到去年12月29日,國會就Aduhelm的審核、定價和行銷提出「充斥着不符合規範的行為」(rife with irregularities)報告的影響。雖然Lecanemab在治療上也有腦腫脹和出血的風險,但FDA仍根據去年11月所發表的臨床試驗結果,Lecanemab在一定程度上減緩了因阿茲海默症而輕度受損的患者的認知能力下降,加速批准Lecanemab。
由民主黨領導的眾議院監督和改革委員會,以及能源和商務委員會,針對聯邦食品暨藥物管理局審核、定價和行銷Aduhelm提出報告指出,其過程「充斥着不符合規範的行為」,審核前與藥廠方面的接觸,未遵守FDA的內部指引及慣例,提出八大疑點。
主導Lecanemab開發的衛采在美國的批發價(a wholesale price)訂為每年2萬6500美元,該藥物將以Leqembi的名稱銷售,美國聯邦醫療保險(Medicare,俗稱紅藍卡)尚未決定是否給付Lecanemab。
2022年1月11日,聯邦醫療服務中心(Centers for Medicare and Medicaid Services,CMS)決議,紅藍卡對於Aduhelm與正在研發中的類似新藥,給付對象僅限參加符合資格臨床實驗的病患,Aduhelm給付將有限制,只適用於少數病患,是否會適用於Lecanemab,引發各界注目。
2022年7月,百健和衛采正式向FDA申請Lecanemab加速審批。基於一種藥物有望比現有藥物更有效地幫助患有嚴重疾病的患者,FDA可以加快批准一種藥物,以便迅速將其推向市場。

FDA神經科學部門主任比利·鄧恩博士(Dr. Billy Dunn)在一份聲明中說:
❝阿茲海默症會極大削弱患者的生活能力,並對他們的親人產生毀滅性的影響。❞
Lecanemab這種治療方案是針對影響阿茲海默症潛在疾病過程的最新療法,而不僅僅是治療疾病的症狀。如果這些試驗證實該藥物具有臨床益處,FDA可以過去傳統審核藥物方式上來批准。但是,如果驗證性試驗沒有顯示出益處,FDA有可能進行促使該藥物退出市場的監管程式。
Lecanemab新藥療效:「適度」延緩疾病,不是治癒
Lecanemab是一種單克隆抗體,靶向阿茲海默症患者大腦中積聚的類澱粉蛋白,不是治癒(not a cure),而是通過與阿茲海默症的標誌β類澱粉蛋白結合起作用。這種抗體每兩周靜脈注射一次,劑量是根據患者體重決定,每公斤注射10毫克。
FDA在聲明中表示,基於在接受該治療的臨床試驗參與者中觀察到的類澱粉斑塊減少,FDA批准了Lecanemab。沒有接受治療的參與者(安慰劑組),類澱粉斑塊沒有減少。
去年11月下旬發表在《新英格蘭醫學雜誌》(New England Journal of Medicine)上的臨床試驗結果發現,在18個月的時間裡,接受lecanemab治療的患者減少了早期阿茲海默症中澱粉蛋白的標記物,認知能力下降速度比未接受該治療的患者(安慰劑組)慢27%。這項研究由百健和衛采資助。
結果還顯示,給予Lecanemab作為靜脈輸注的試驗參與者中,約有6.9%因不良事件而停止試驗,而給予安慰劑的受試者中這一比例為2.9%。總體而言,14%的Lecanemab組和11.3%的安慰劑組存在嚴重不良事件。
Lecanemab組中最常見的不良事件是對靜脈輸注的反應和磁振造影(MRI)異常,例如腦腫脹和腦出血,稱為類澱粉蛋白相關影像異常(ARIA, amyloid-related imaging abnormalities),這可能危及生命。
ARIA「最常表現為特定大腦區域的短暫腫脹(腦腫脹),通常會隨著時間的推移而循環,並可能伴有大腦內部或表面的小出血點(腦出血)。」
一些感染ARIA的人可能沒有症狀,但偶爾會導致住院或持續損傷。在擁有APOE4基因的人群中,ARIA的頻率似乎更高,這可能會增加患阿茲海默症或其他認知症的風險。研究表明,在APOE4非攜帶者中,ARIA「在數量上不太常見」。
FDA表示,該藥物的處方資訊帶有有關ARIA的警告。
試驗結果還顯示,Lecanemab組約0.7%的參與者和安慰劑組0.8%的參與者死亡,相當於Lecanemab組有6人死亡,安慰劑組有7人死亡。
認知能力下降是用一種叫做臨床認知症評分(CDR-SB)的系統來衡量的,它是一個18分制的量表,得分愈高表明受損程度愈高。它衡量的是諸如記憶、判斷和解決問題等認知功能。
阿茲海默症在接受Lecanemab治療的組中平均惡化1.21分,而未接受該治療的組中平均惡化1.66分,差異為0.45分。
近1800名年齡在50至90歲之間的早期阿茲海默症患者參與了這項試驗,其中約一半人接受了Lecanemab治療,另一半人為安慰劑組。
美國阿茲海默症協會對FDA的決定表示歡迎。基於2021年FDA審核Aduhelm時,該協會主動遊說並刊登廣告希望FDA應考慮美國650萬阿茲海默症患者及其家庭,盡速給予通過,最後基於安全及價格等因素,Aduhelm上市遭遇極大阻力,聯邦醫療服務中心縮小美國聯邦醫療保險給付對象,有此前車之鑑,這次阿茲海默症協會的作為略為保留,該協會總裁兼首席執行官Joanne Pike為名發表歡迎的新聞稿。
美國有線電視訪問佛羅里達大西洋大學施密特醫學院腦健康中心阿茲海默症預防診所主任(director of the Alzheimer’s Prevention Clinic in the Center for Brain Health at Florida Atlantic University’s Schmidt College of Medicine.) 理察以撒森博士(Richard Isaacson)指出,對於FDA加速批准lecanemab,是意料之中的事,他會以安全為優先考量,使用lecanemab。
他表示,lecanemab可以成為他幫助患者的工具箱中對抗阿茲海默症的「另一種工具」。
以撒森博士表示,由於這種藥物並不適合所有人,他會以正確的劑量和非常仔細的監測方式來開立這種藥物。
他會先對APOE4進行基因檢測。會與患者進行坦率的討論,以撒森博士表示,如果有人有副作用,如果有人正在服用血液稀釋藥物,如果有人有問題,患者需要與治療醫生討論這個問題,患者需要立即尋求醫療救助。
參考資料:
1. FDA Grants Accelerated Approval for Alzheimer’s Disease Treatment
FDA For Immediate Release:
January 06, 2023
2. Alzheimer’s drug lecanemab receives accelerated approval amid safety concerns
CNN By Jacqueline Howard and Brenda Goodman, Updated 5:15 PM EST, Fri January 6, 2023
3. Breaking: FDA clears second Alzheimer's drug in 'foundational spark' for field
Kyle LaHucik Associate Editor January 6, 2023 02:19 PM EST
4. 減緩27%認知衰退!阿茲海默症新藥「Lecanemab」實驗研究出爐,但副作用被關注
(本文作者為認知症整合照護專家,長照、認知症政策研究者)

 Just For You
Just For You
